Das PCR-Verfahren kurz erklärt
Seit der COVID19-Pandemie ist die PCR breiten Teilen der Bevölkerung bestens bekannt. PCR steht für „Polymerase Chain Reaction“ bzw. „Polymerase-Kettenreaktion“, ein Nachweisverfahren für genetische Erbinformationen (DNA bzw. RNA). Farbmarkierte Gensonden, sogenannte Primer, suchen nach identischen Genabschnitten. und docken an. Stimmen die Erbinformationen überein, können sie andocken und der markierte Genabschnitt wird kopiert. Dieser Schritt lässt sich beliebig wiederholen und wird als Zyklus bezeichnet. Bei jedem Zyklus verdoppelt sich die Menge an farbigen Kopien. Es handelt sich um eine verzweigte Kettenreaktion mit exponentiellem Verlauf. Spätestens nach 35 bis 40 Zyklen sind die farbmarkierten Gen-Kopien so oft kopiert, dass sie mit einem Farbdetektor gemessen werden können (Abb.2). Der PCR-Test ist positiv. Je mehr Zellen, Bakterien oder Viren mit den gesuchten Erbinformationen vorhanden sind, desto weniger Zyklen sind bis zum Leuchten der Farbe notwendig. Das PCR-Gerät misst die Anzahl der dafür erforderlichen Zyklen. Das Ergebnis ist der sogenannte „Ct-Wert“. Ein niedriger Ct-Wert steht für viele Zellen, Bakterien oder Viren in der Probe.
Gegenüber Anzüchtungen im Brutschrank hat die PCR mehrere Vorteile. Zum einen ist das Verfahren sehr schnell. Eine klassische PCR benötigt etwa eine Stunde, während Bakterienkulturen mehrere Tage wachsen müssen. Zum anderen kann die PCR sehr genau bestimmen, wie viele Keime vorhanden sind. Bei einer Anzüchtung vermehren sich die Keime ähnlich wie bei der PCR in Form einer Kettenreaktion. Am Ende des Wachstums erfolgt die Messung der Bakterienzahl. Diese sogenannte Endpunktmessung ist nicht genau. Die Keime vermehren sich unkontrolliert und mit unterschiedlichen Geschwindigkeiten. Das führt zwangsläufig zu Verzerrungen. Die PCR kann die Anzahl der Keime direkt in der Probe ohne eine vorherige Anzucht messen. Die Messung erfolgt nicht erst am Endpunkt, sondern online während der gesamten Reaktion. Dadurch werden Verzerrungen vermieden. Außerdem verläuft die Reaktion unter einheitlichen und kontrollierten Bedingungen. Die Anzahl der gemessenen Keime kann mit einer sogenannten Referenz abgeglichen werden. Als Referenz dient in der Regel eine gleichmäßig verteilte Erbanlage der Zellen. Die Menge dieser Erbanlagen korreliert mit der Anzahl an Zellen in der Probe. Das Verfahren ist sehr genau und wird als relative Quantifizierung bezeichnet. Das Messergebnis wird durch den Referenzwert geteilt und damit auf Anzahl der Zellen in der Probe relativiert. Die PCR-Messungen lassen sich auf diese Weise direkt vergleichen, unabhängig von der Größe und der Qualität der Probe. Vereinfacht dargestellt handelt es sich bei dem Ergebnis um die Anzahl der Keime / Zelle in der jeweiligen Probe.
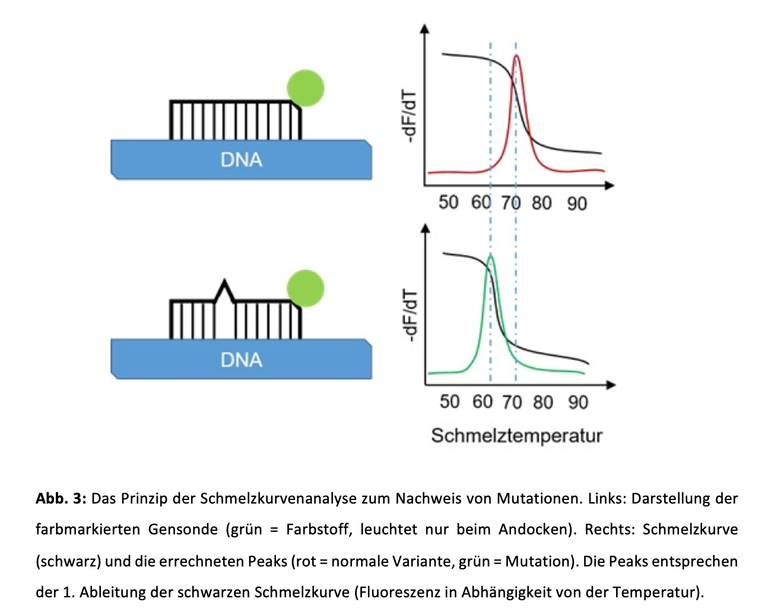
Die PCR kann zusätzlich einzelne Genveränderungen erkennen, sogenannte Mutationen. Nach der PCR wird die Temperatur langsam erhöht und das Farbsignal der angedockten Gensonden kontinuierlich gemessen. Das Ergebnis wird als Schmelzkurve bezeichnet. Sobald sich die Gensonden ablösen, fällt das Farbsignal rasant ab. Der sogenannte Schmelzpunkt wurde erreicht. Bei einer Mutation binden die Gensonden durch den Fehler (sogenannter Mismatch) nicht vollständig und lösen sich leichter ab. Der Schmelzpunkt hat eine niedrigere Temperatur und wird früher erreicht. Jede Variante hat einen eigenen Schmelzpunkt, z.B. 71°C bei der normalen Variante und 62°C bei der mutierten Variante. Damit lassen sich Mutationen zuverlässig erkennen. Zur besseren Auswertung errechnet das PCR-Gerät aus der Schmelzkurve „Peaks“. Mathematisch handelt es sich dabei um die „erste Ableitung“ (Abb. 3).
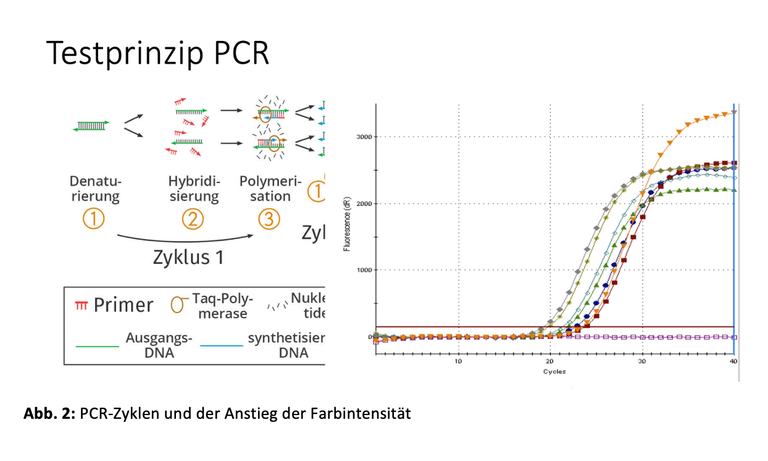
PCR-Zyklen und Messung
Bei jedem Zyklus steigt die Farbintensität an. Sobald die Signale der Sonden gemessen werden können, ist der Test positiv.
Schmelzkurvenanalyse
Zum Abschluss der PCR wird der Abfall der Farbintensität bei steigenden Temperaturen gemessen. Liegt eine Mutation vor, fällt das Signal früher, also bei niedriger Temperatur.
© Urheberrecht. Alle Rechte vorbehalten.
